Methode
Das Q5® Site-Directed Mutagenesis Kit ermöglicht Ihnen die gerichtete Mutagenese von den verschiedensten Ausgangsplasmiden in nur 2 Stunden. Durch die Verwendung von Mutagenese-Primern und der Q5 Hot Start High-Fidelity DNA Polymerase fügen Sie sowohl Punktmutationen (Basenaustausche), als auch Deletionen und Insertionen in Plasmide mit einer Länge von bis zu 14 kb ein.
Das Amplifikat behandeln Sie nachfolgend für nur 5 Minuten bei Raumtemperatur mit dem einzigartigen Kinase-Ligase-DpnI (KLD) Enzym-Mix.
Dadurch wird:
- das mutierte PCR-Amplifikat kinasiert
- somit das Plasmid rezirkularisiert und
- die nicht-mutierte Template-DNA durch den Verdau mit DpnI entfernt*.
Anschließend transformieren Sie Ihr mutiertes Plasmid in die mitgelieferten hoch effizienten NEB 5-alpha Competent E. coli und erhalten eine Vielzahl an korrekten Klonen.
* bei der Verwendung von dam+/dcm+ E. coli Stämmen
- Einfügen von Punktmutationen, Deletionen oder Insertionen in beliebige Plasmide in weniger als 2 h
- Extreme Genauigkeit („proof-reading“) der Q5 DNA Polymerase ermöglicht die Anwendung bei Plasmiden bis 14 kb Länge
- Exzellente Ausbeuten dank „back-to-back“ Primer-Strategie und PCR-Amplifikation
- Praktischer PCR Master Mix und KLD Mix für Zuverlässigkeit und Komfort
- Einfache und schnelle „Ein-Schritt-Reaktion“ für Kinasierung, Ligation und DpnI-Verdau in nur 5 min dank innovativem KLD-Master Mix
- Hoch-kompetente NEB 5-alpha E. coli Zellen für zuverlässige Transformationen im Kit enthalten
Erfahren Sie mehr über das Q5 Site-Directed Mutagensis Kit!
Tipp:
![]() Nutzen Sie für das Design der Mutagenese-Primer das kostenfreie NEBaseChanger Tool!
Nutzen Sie für das Design der Mutagenese-Primer das kostenfreie NEBaseChanger Tool!
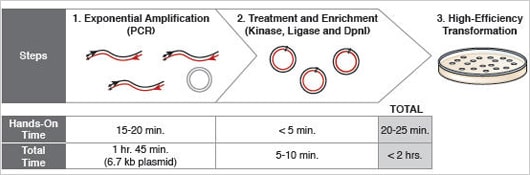
Abbildung 1: Gerichtete Mutagenese in weniger als 2 Stunden
Die Verwendung des Q5® Hot Start High-Fidelity Master Mix und des einzigartigen KLD Enzym-Mix gewährleisten für die meisten Plasmide eine vollständige Mutagenese in weniger als 2 Stunden
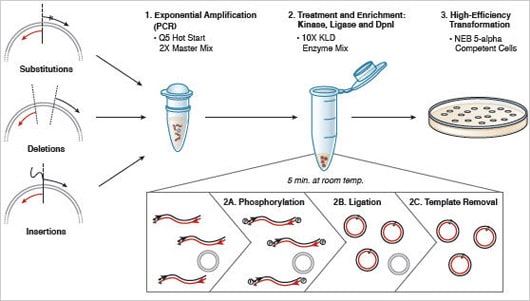
Abbildung 2: Q5® Site-Directed Mutagenesis Kit Überblick
Das Q5® Site-Directed Mutagenesis Kit wurde entwickelt um schnell und effizient Insertionen, Deletionen und Substitutionen in Doppelstrang-DNA einzuführen. Im ersten Schritt wird das Template durch die Verwendung von Standardprimern und der Q5® Hot Start High-Fidelity DNA Polymerase exponentiell amplifiziert. Im zweiten Schritt wird mit dem KLD Enzym Mix inkubiert. Dabei kommt es zu Ligation der PCR-Produkte und zur Entfernung der Template DNA. Als Letztes folgt die Transformation in die mitgelieferten, kompetenten Zellen.
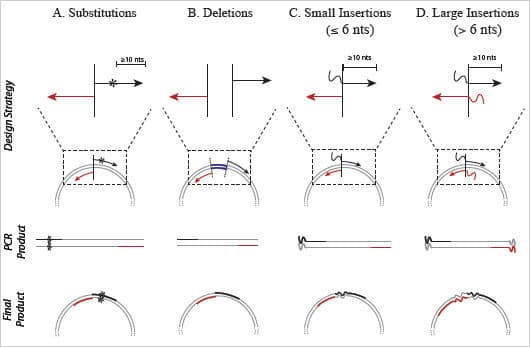
Abbildung 3: Primer Design für das Q5® Site-Directed Mutagenesis Kit
Durch das Design von speziellen forward (schwarz) und reverse (rot) Primern, können Substitutionen, Deletionen und Insertionen in das Ursprungsplasmid eingebracht werden. Anders als bei anderen, gängigen Kits mit linearer Amplifikation sollten die Primer bei der Verwendung des Q5® Site-Directed Mutagenesis Kit nicht überlappen, um eine exponentielle Amplifikation zu gewährleisten.
A) Substitutionen können erzeugt werden (dargestellt durch *), indem das Nukleotid in der Mitte des forward Primers variiert wird, mit mindestens 10 komplementären Nukleotiden am 3’Ende der Mutation. Der reverse Primer wird so entworfen, dass die 5’Enden der beiden Primer Rücken-an-Rücken angelagert werden.
B) Deletionen werden durch nicht mutagene Primer erzeugt, die die zu entfernende Region des Plasmids umschließen.
C) Insertionen mit 6 oder weniger Nukleotiden werden erzeugt, indem sie an das 5’Ende des forward Primer angehangen werden, während der reverse Primer mit dem 5’Ende Rücken-an-Rücken mit der komplementären Region des forward Primers beginnt.
D) Größere Insertionen entstehen, indem jeweils die Hälfte der Insertionen an das 5’Ende der beiden Primer addiert wird. Die Größe dieser Insertion wird weitestgehend limitiert durch die Einschränkungen bei der Oligonukleotid-Synthese.
Vergleich mit anderen Methoden
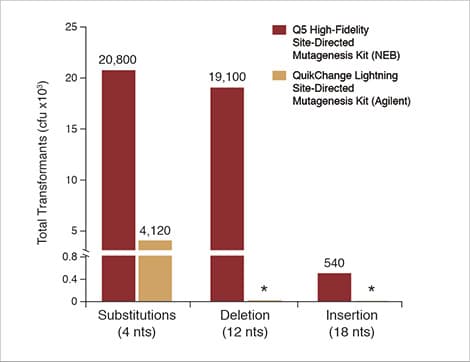
Höhere Transformations-Effizienzen mit dem Q5® Site-Directed Mutagenesis Kit
Die Abbildung zeigt die Ergebnisse einer Substitutionsreaktion (4 Nukleotide) mit dem back-to-back Control SDM Primer Mix und dem Control SDM Plasmid (6,7 kb), eines Deletions-Experimentes (12 Nukleotide, 5,8 kb Plasmid) und eines 18 Nukleotide Insertions-Experimentes (7,0 kb Plasmid). In allen Fällen zeigen über 90% der Kolonien die gewünschten Mutationen. Zum Vergleich wurde die gleiche Substitutionsreaktion (4 nt) mit dem QuikChange Lightning Site-Directed Mutagenesis Kit (Agilent) nach Herstellervorgaben und unter Zuhilfenahme des entsprechenden Primer-Design-Tools durchgeführt (*Anmerkung: Mit dem QuikChange Kit können keine Deletionen oder Insertionen vergleichbarer Größe eingeführt werden).
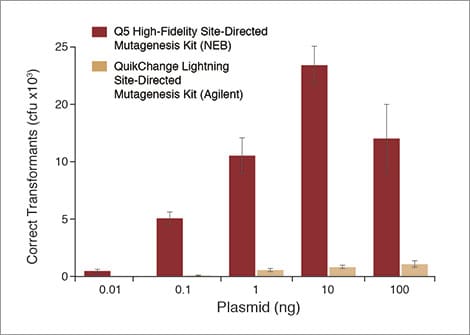
Höhere Ausbeuten an korrekten Klonen mit dem Q5® Site-Directed Mutagenesis Kit
Eine Substitutionsreaktion (4 Nukleotide) mit dem back-to-back Control SDM Primer Mix und dem Control SDM Plasmid (6,7 kb) wurde mit unterschiedlichen Mengen Plasmid durchgeführt. Zum Vergleich wurde der gleiche Versuch mit dem QuikChange Lightning Site-Directed Mutagenesis Kit (Agilent) nach Herstellervorgaben und unter Zuhilfenahme des entsprechenden Primer-Design-Tools durchgeführt.
Weiterführende Informationen finden Sie unter Technische Ressourcen oder auf neb.com. Informationen zu Namensrechten finden Sie hier.